Ma Zhiguang, Zhang Fang, Di Na, Liu Suwen, Liu Pan
(College of Chemistry and Environmental Science, Hebei University, Baoding 071002)
AbstractKinetics and thermodynamics of the adsorption of Ni2+ onto chitosan-aluminium oxide composite material was studied. Under the experimental conditions, kinetic studies indicated that adsorption of Ni2+ onto chitosan-aluminium oxide composite material conforms to pseudo-second-order equation and the apparent adsorption activation energy is 28.62kJ/mol.In the experimental temperature, thermodynamic studies indicated that adsorption of Ni2+ onto chitosan-aluminium oxide composite material conforms to Langmuir adsorption isotherm equation. Enthalpy of adsorption (H) value is 15.93kJ/mol and entropy of adsorption(S)value is 95.43J/(mol· K).Gibbs free energy (G) decreases with increasing temperature.
壳聚糖-铝氧化物复合材料对Ni2+的吸附动力学及热力学研究
马志广,张方,邸娜,刘素文,刘盼
(河北大学化学与环境科学学院,河北 保定 071002)
摘要 研究了Ni2+在壳聚糖铝氧化物复合材料上吸附的动力学和热力学。研究表明,在实验条件下该吸附符合伪二级动力学方程,吸附表观活化能=28.61kJ/mol;热力学研究表明,在实验温度下吸附符合Langmuir等温方程,吸附焓变=15.93kJ/mol,熵变=95.43J/mol.K,吸附吉布斯自由能数值随温度升高而减小。
关键词 壳聚糖 复合材料 吸附 动力学 热力学
镍是污水排放中严格控制的第一类污染物。含镍废水主要来自冶炼厂和电镀厂,进入水体后,镍不能被微生物降解,却能通过水生生物大量富集并进人食物链危害人类。吸附法是去除工业废水中Ni2+的主要方法之一。
壳聚糖是天然高分子材料甲壳素经脱乙酰化反应后得到的产物,分子链上存在大量的羟基和氨基,可作为吸附剂用于废水中重金属离子的吸附[1]。但是壳聚糖分子链间和分子链内部氢键的存在而影响了吸附能力,耐酸性差且机械强度等有待进一步提高。谢光勇等[2]以壳聚糖和异丙醇铝为原料,采用化学键合方法制备了壳聚糖-铝氧化物复合材料,对铜离子和汞离子的吸附性能得到了较大改善,稳定性得到了提高。
研究壳聚糖-铝氧化物复合材料对溶液中Ni2+的吸附动力学和热力学特征,有助于探讨复合材料吸附水溶液中金属离子的规律。
1 实验部分
1.1仪器与试剂
紫外可见分光光度计(WFZ800-D3A型,北京第二光学仪器厂);水浴振荡器;电子天平。
壳聚糖(脱乙酰度>90%,浙江金壳生物化学有限公司);异丙醇铝(分析纯,国药集团化学试剂有限公司);NiSO6HO、甲苯、乙醇等均为分析纯。
1.2实验方法
参考文献[2]中所述方法,在装有回流冷凝管的氮气保护的250mL三口瓶中依次加入100mL干燥甲苯和3g异丙醇铝,50℃下磁力搅拌30min后,再加入10g壳聚糖,升温至112℃,回流5h停止反应,过滤后依次用无水甲苯、无水乙醇、蒸馏水分别洗涤产物6次。最后将产品放入80℃烘箱中烘干即得壳聚糖-铝氧化物复合材料。
准确称取0.5000±0.0002g复合材料置于50ml的锥形瓶中,然后准确移取20ml含已知浓度的硫酸镍溶液,放入水浴振荡器,在设定温度下振荡(130r× min-1)一定时间后快速过滤,取滤液用紫外-可见分光光度计测定721nm处的吸光度值,根据标准曲线计算剩余Ni2+浓度。吸附量按(1)式计算:
Q= (C-C)× V/m (1)
式中,Q为吸附量(mmol× g-1);C和C分别为溶液中Ni2+的初始和吸附结束时的浓度(mol× L-1);V为溶液的体积(mL);m为吸附剂质量(g)。
2 结果与讨论
2.1复合材料对Ni2+的吸附的动力学研究
在不同时间和温度下,复合材料对浓度为0.1200mol× L-1Ni2+的吸附动力学曲线见图。
由图可知,复合材料对Ni2+的吸附具有较好的吸附性能。此吸附基本符合溶液中物质在多孔性吸附剂上吸附的个必要步骤[3,4]。开始时,吸附速率较快,且随时间的延长而有规律的减小,360 min后趋于平衡。这是因为在开始时,Ni2+主要被吸附在复合材料的外表面,吸附较快;随着吸附过程的进行,Ni2+的浓度逐渐减小,同时吸附质沿复合材料微孔向内部扩散,扩散阻力渐增,吸附速率主要受扩散控制,导致吸附速率变慢;吸附后期主要在吸附剂内表面吸附,且浓度推动力越来越小,吸附已基本达到平衡。当温度升高时,由于活化分子百分数增大,从而使吸附速率增大。
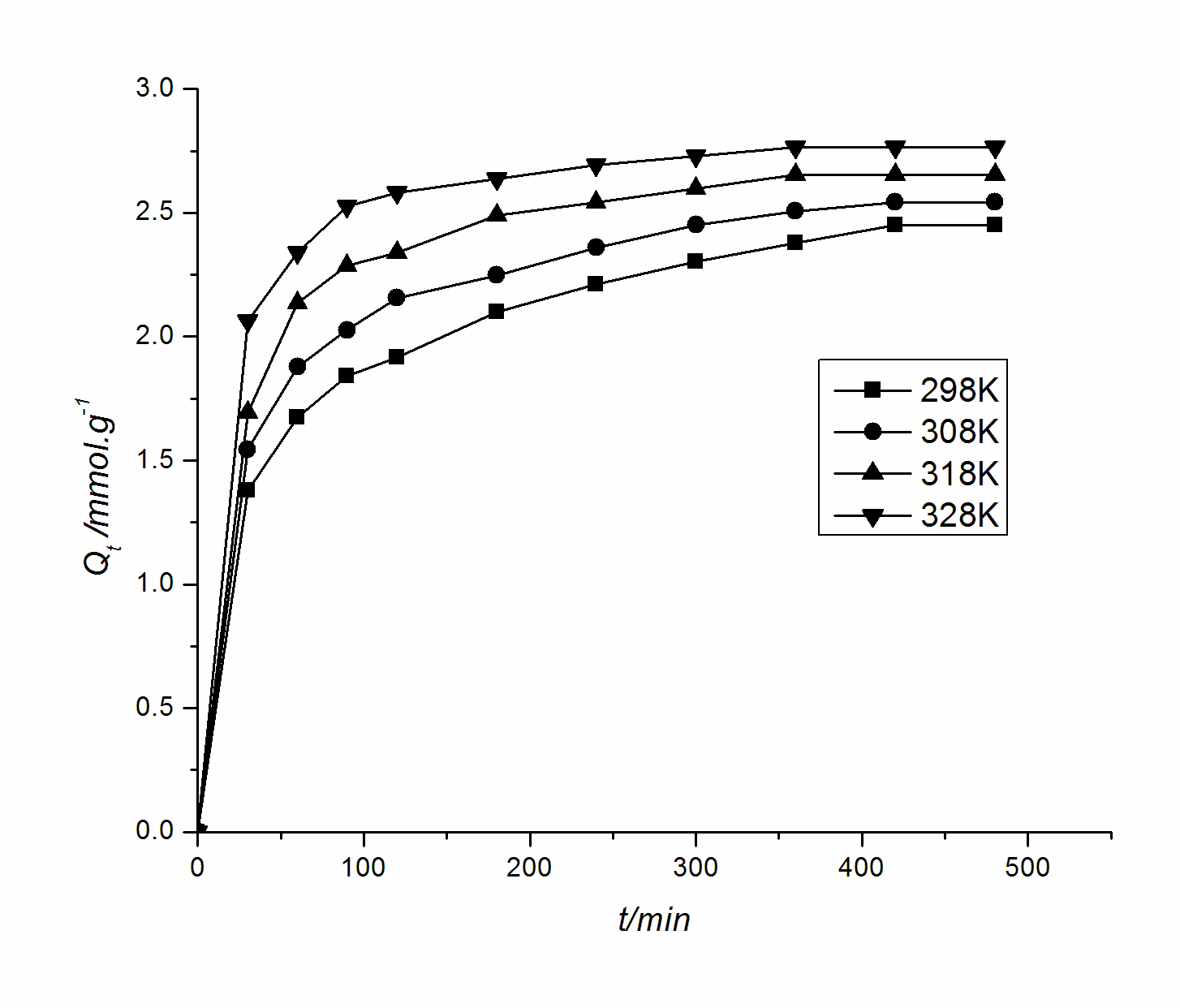
图不同温度下壳聚糖铝氧化物复合材料吸附Ni2+的动力学曲线

图伪二级动力学方程曲线
伪二级动力学模型是以吸附速率由吸附剂表面上未被占有的吸附空位数目的平方值决定的假设为基础的[5],其公式为
dQ/dt=k(Qeq-Q (2)
对式(2)积分并利用边界条件可得到
t/Q = t/Qeq +1/kQeq (3)
式中Q为吸附时间为t(min)时的吸附量(mmol× g-1); Qeq为平衡吸附量(mmol× g-1);k是表观吸附速率常数(g× mmol-1× min-1)。
符合伪二级动力学模型的吸附,t/Q与t呈线性关系。对图1中的数据进行伪二级动力学方程拟合,可得曲线(见图2)斜率和截距,并分别求得Qeq和k值(见表1)。
表1不同温度下的吸附动力学参数
| T/K | eq/(mmol× g-1 | k/(g× mmol-1× min-1 | |
| 298 | 2.6312 | 0.00992 | 0.99813 |
| 308 | 2.6917 | 0.01301 | 0.99926 |
| 318 | 2.7729 | 0.01831 | 0.99984 |
| 328 | 2.8418 | 0.02876 | 0.99993 |
以lnk对1/T作图得一条直线,其相关系数为R=0.9798。根据Arrhenius方程求得吸附表观活化能E=28.62kJ× mol-1。

图 不同温度下的吸附等温线

图4 Langmuir拟合方程等温线
2.2复合材料对Ni2+的吸附的热力学研究
由图可知,随着Ni2+初始浓度的增加,复合材料对Ni2+的吸附量也随之增加,而后变化缓慢,趋于最大值。这是由于在复合材料投加量不变的情况下,吸附位点数量有限,当初始Ni2+浓度较低时,可以提供充足的活性位点用于吸附,因而复合材料吸附量增大[6]。而当初始Ni2+浓度较高时,活性位点则相对不足,导致吸附位点达到饱和,因而当Ni2+浓度达到0.25mol× L-1以上,复合材料对Ni2+的吸附量几乎趋于一定值。
Langmuir吸附模型满足: eq/Qeq=Ceq/Q+1/K (4)
式中为饱和吸附容量(mmol× g-1);eq和eq分别为溶液中金属离子平衡浓度(mmol× L-1)和吸附容量(mmol× g-1);为平衡常数(× mmol-1)。
将实验数据按照Langmuir吸附模型进行拟合得图。由图可以看出,复合材料对Ni2+的吸附与Langmuir方程符合的很好,为单分子层吸附。由表可得:随着温度的升高,复合材料的饱和吸附量和Langmuir平衡常数也随之增大,因此可以看出该吸附属为吸热过程,提高温度有利于吸附的进行。
表 Langmuir 吸附等温线方程和参数
| T/K | Langmuir equation | /(mmol× g-1 | /(L× mmol-1 | |
| 298 | eq/eq=0.37413Ceq+2.47580 | 2.673 | 0.1511 | 0.99986 |
| 308 | eq/Qeq=0.36360Ceq+1.82621 | 2.750 | 0.1991 | 0.99995 |
| 318 | eq/Qeq=0.35394Ceq+1.49414 | 2.825 | 0.2369 | 0.99996 |
| 328 | eq/Qeq=0.34313Ceq+1.25473 | 2.914 | 0.2735 | 0.99998 |
*实验中Ni2+浓度在0.08mol× L-1.4mol× L-1,吸附时间为420min。
K随温度变化关系由Van’t Hoff方程式[7]给出:
lnK= -/RT+/R (5)
式中,(J× mol-1和(J× mol-1× K-1分别为吸附过程的焓变和熵变;为理想气体常数;()为温度。ln-1/呈线性(= 0.9840),斜率和截距分别等于/R和/R,由此得到15.93 kJ× mol-1,=95.43J× mol-1× K-1。各温度下的计算结果列于表。
表不同温度下壳聚糖铝氧化物复合材料吸附Ni2+的
| T/ | 298 | 308 | 318 | 328 |
| /(kJ× mol-1 | -12.51 | -13.46 | -14.41 | -15.37 |
4个温度下的吉布斯自由能变化都小于零,而且温度越高,越小,揭示了复合材料对Ni2+的吸附过程是一个自发的,且温度越高自发的程度越大。>0表明该吸附是吸热过程,温度升高时反应体系的能量增加,同时吉布斯自由能降低,有利于对Ni2+的吸附,故吸附量增加。
3 结论
壳聚糖铝氧化物复合材料对水溶液中Ni2+的吸附符合伪二级吸附动力学特征;吸附表观活化能=28.62kJ× mol-1。壳聚糖铝氧化物复合材料对离子的吸附在所研究的Ni2+浓度范围内符合Langmuir等温吸附式,并得到了吸附热力学参数。
